Czasopismo Etnofarmakologiczne 137 (2011) 403–413
Zróżnicowany wpływ mechanizmu przciwprzerzutowego produktu w płynie Tian-Xian (TXL) i jego bioaktywnych składników na modele ludzkich nowotworów złośliwych jelita grubego.
E.S.M. Chu a , S.C.W. Sze a , H.P. Cheung a , K.L. Wong a , Q. Liu a , T.B. Ng b , Y. Tong a,∗
a Szkoła Medycyny Chińskiej, Wydział Medyczny LKS, Uniwersytet w Hong Kongu, 10 Sasson Road, Pokfulam, Hong Kong, Chiny
b Szkoła Nauk Biomedycznych, Wydział Medyczny, Chiński Uniwersytet w Hong Kongu, Shatin, Hong Kong, Chiny
INFORMACJE DOTYCZĄCE ARTYKUŁU
Historia artykułu:
Otrzymany 14 luty 2011
Otrzymany po poprawkach 17 kwiecień 2011
Zaakceptowany 30 May 2011
Dostępny online 6 czerwiec 2011
Słowa kluczowe:
Chiński produkt leczniczy
Tian-Xian w płynie
Metaloproteinaza macierzy pozakomórkowej
Czynnik wzrostu komórek śródbłonka naczyń
Przeciwprzerzutowy
Nowotwór złośliwy jelita grubego
ABSTRAKT
Cel badania: Celem badania jest wyjaśnienie i porównanie mechanizmu przeciwprzerzutowego produktu Tian-Xian w płynie (TXL) i jego bioaktywnych składników: butanolu (BU), octanu etylowego (EA) i wodnych cząsteczek (WA) na nowotwór złośliwy jelita grubego w testach in vitro (komórki nowotworowe HT-29) i testach in vivo (przeszczepy ksenogeniczne u nagich myszy ang. nude mice).
Materiały i metody: Efekty antyproliferacyjne produktu TXL i jego bioaktywnych składników w komórkach HT-29 określone były przy użyciu testu MTT. Modulacje potencjalnych ekspresji genów będących markerami angiogenicznymi i markerami przerzutów komórek HT-29 i przeszczepów ksenogenicznych (ksenograftów) były badane przy użyciu metody real-time PCR i techniki Western blot na poziomie odpowiednio transkrypcji lub translacji. W badaniu in vitro zdolności do migracji komórek HT-29 były określone przy użyciu testu Wound Healing. W badaniu in vivo wykonywane były również dzienne pomiary wielkości oraz objętości guza przeszczepów ksenogenicznych.
Wyniki: TXL, BU, EA i WA efektywnie hamowały proliferację komórek HT-29 w zależności od podanej dawki i czasu. Wartość IC50 produktu TXL na komórki HT-29 została osiągnięta po inkubacji z 1% (v/v) TXL przez 4 h; podczas gdy dla poszczególnych bioaktywnych komponentów otrzymano następujące wartości IC50:BU z 1,25% (v/v); EA z 5% (v/v); and WA z 0,3125% (v/v). Stwierdzono, że 1% (v/v) TXL znacznie ograniczył ekspresję MMP2 i MMP7 zarówno na poziomie transkrypcji jak i translacji oraz zmniejszył ekspresję MMP9 i białka VEGF w in vitro. TXL zmniejszył zdolność do przerzutów komórek HT-29 jak przedstawiono w teście wound healing. TXL i jego bioaktywne substancje nie spowodowały żadnych znacznych zmian w wadze ciała wykazując przy tym brak toksyczności dla przeszczepów ksenogenicznych.
Wnioski: Podsumowując, TXL jest produktem o wilokierunkowym działaniu ograniczającym markery przerzutów zarówno w modelach in vitro jak i in vivo. Nie mniej jednak skuteczność jego bioaktywnych substancji nie była oczywista. To badanie gruntownie wyjaśniło mechanizm przeciwproliferacyjny produktu TXL, który jest kluczowy dla powstania przyszłych suplementów przeciwnowotworowych w chińskich preparatach leczniczych.
© 2011 Elsevier Ireland Ltd. Wszelkie prawa zastrzeżone.
1. Wstęp
Tradycyjne chińskie produkty lecznicze (TCMs), znane również jako medykamenty ludowe z ich wyjątkowym, systematycznym podejściem, były stosowane w Chinach przez kilka tysięcy lat. Te ziołowe lekarstwa wykazują właściwości przeciwnowotworowe i od dłuższego czasu były stosowane w leczeniu nowotworów złośliwych (Jonas, 1998; Yuan i Lin, 2000; Gao et al., 2007; Huang et al., 2008). Jednakże naukowe mechanizmy ich skuteczności muszą zostać zbadane (Cho i Chen, 2009). Aby pogłębić wiedzę o roli tradycyjnych, chińskich produktów leczniczych w badaniach nad nowotworami, atrybuty tych ziołowych środków oraz sprzeczne wyniki związane z ich skutecznością zasługują na dalsze badania przed przeprowadzeniem testów klinicznych (Ruan et al., 2006).
----------------- Skróty: FBS, bydlęca surowica płodowa; MMP2, metaloproteinaza macierzy 2; MMP7, metaloproteinaza macierzy 7; MMP9, Metaloproteinaza macierzy 9; PBS, wodny roztwór soli fizjologicznej buforowanej fosforanami; SDS, sodium dodecyl sulfate - sodu dodecylosiarczan; TBS-T, wodny roztwór soli fizjologicznej buforowany Trisem Tween-20, TXL, Tian-Xian płyn; VEGF, Czynnik wzrostu komórek śródbłonka naczyń.
Źródła finansowania: Badanie zostało sfinansowane w części przez dotację z Programu Seed Funding for Applied Research (no.: 200807160015) i umowę o finansowanie badań przez firmę China-Japan Feida Union Company Limited. ∗ Dane kontaktowe autora. Tel.: +852 2589 0476; fax: +852 2872 5476. E-mail address: tongyao@hku.hk (Y. Tong). 0378-8741/$ – patrz powyżej © 2011 Elsevier Ireland Ltd. Wszelkie prawa zastrzeżone. doi:10.1016/j.jep.2011.05.035
Tian-Xian płyn był używany komercyjnie jako przeciwnowotworowy suplement dietetyczny przez ponad 10 dni bez jakichkolwiek znanych efektów niepożądanych (Sun et al., 2004). TXL jest wodnym ekstraktem z chińskiej mieszanki ziół zawierającej głównie 10 chińskich ziół leczniczych: Korzeń żeń-szenia, Cordyceps, Korzeń traganka błoniastego (Radix Astragali), korzeń Lukrecji (Radix Glycyrrhizae), owoc Kolcowoju (Jagody Goji), Proszek perłowy (Margarita), owoc Lycium (Fructus Lycii), Lakownica (Ganoderma), Ligustr lśniący (Fructus Ligustri Lucidi) i ziele Tarczycy brodatej (Herba Scutellariae Barbatae). Wcześniejsze eksperymenty dowiodły, że TXL wykazywał działanie hamujące na różne nowotwory złośliwe, w tym także nowotwory szyjki macicy, płuc oraz piersi (Sun et al., 2005a,b; Chia et al., 2010). Nasz zespół przeprowadził kontrolę jakościową produktu TXL i zbadał jego działanie cytotoksyczne przy nowotworach jelita grubego w testach in vitro i in vivo (Sze et al., 2011). Obecnie nadal badamy i porównujemy skuteczność przeciwprzerzutową produktu TXL i jego substancji na ludzki nowotwór złośliwy jelita grubego w testach in vivo i in vitro, aby dowieść wielokierunkowego działania produktu TXL na nowotwór złośliwy jelita grubego.
Nowotwór złośliwy jelita grubego jest ciągle na drugim miejscu co do częstotliwości występowania w Hong Kongu, a na zachodzie sytuowany jest w rankingach jako trzecia główna przyczyna zgonów (Hong Kong Cancer Registry, 2007). W ostatnim dziesięcioleciu irynotekan, oxaliplatin i standardowa chemioterapia oparta na fluorouracylu ustanowiła nowy punkt odniesienia czasu przeżycia pacjentów z nowotworem jelita grubego z przerzutami (Prat et al., 2007). Jednak pomimo tych terapeutycznych postępów, ciągle istnieje zapotrzebowanie na bardziej efektywne i lepiej tolerowane przez pacjentów terapie leczenia nowotworu złosliwego jelita grubego. Dlatego też, koniecznością jest opracowanie nowych schematów leczniczych w zwalczaniu tej choroby.
Angiogeneza jest potrzebna do zapoczątkowania przerzutów podczas gdy migracja powoduje szybkie rozprzestrzenianie się komórek nowotworowych. Identyfikacja kluczowych aminokwasów w tych procesach, takich jak metaloproteinaza macierzy (MMPs), jest ważna dla opracowania nowych i skutecznych schematów leczenia nowotworów złośliwych. Przerzuty nowotworowe są skomplikowanym i wieloetapowym procesem zachodzącym w mikrośrodowisku guza (Polette et al., 2004). Jednym z decydujących czynników przerzutów nowotworowych jest wysoka produkcja enzymów proteolitycznych, macierzowych metaloproteinaz (MMPs), które odgrywają główną rolę w degradacji błony podstawnej i macierzy zewnątrzkomórkowej (ECM) (Eccles and Welch, 2007). Macierzowe metaloproteinazy (MMPs) należą do dużej grupy enzymów zależnych od cynku i wapnia. Macierzowe metaloproteinazy są początkowo w stanie enzymatycznie nieaktywnym z powodu interakcji osadu cysteiny prodomeny z miejscem katalitycznym jonów cynku. Dopiero po przerwaniu interakcji poprzez przełącznik cysteinowy, który jest zazwyczaj pośrednikiem w preolitycznym usunięciu prodomeny lub chemicznej modyfikacji osadu cysteiny, enzym staje się proteolitycznie aktywny. Prodomena wymaga proteolitycznego podziału za pomocą enzymu konwertującego (aktywacji) i jest katalizowana wewnątrzkomórkowo przez furynę lub zewnątrzkomórkowo przez inne macierzowe metaloproteinazy lub proteazy seryny takie jak plazmina (Sternlicht and Werb, 2001). Główne macierze metaloproteinazy w angiogenezie guza to MMP2, 9 i 14 oraz w mniejszym stopniu MMP1 i 7 (Kessenbrock et al., 2010). MPP2 jest szeroko rozpowszechnioną kolagenazą typu IV zwaną żelatynazą A, która zbiera się na ujściu komórki nowotworowej, aby ułatwić ograniczony i zkoordynowany rozpad bariery macierzy zewnątrzkomórkowej (EMC). Dowiedziono, że wysoki poziom tkanki MMP2 jest związany z niskim prawdopodobieństwem przeżycia pacjentów z nowotworami żołądka (Turpeenniemi-Hujanen, 2005). MMP9 odgrywa dużą rolę w angiogenezie guza. Reguluje głównie biodostępność naczyniowo-śródbłonkowego czynnika wzrostu (VEGF), który jest najsilniej działającym wyzwalaczem angiogenezy guza i głównym celem terapeutycznym (Turpeenniemi-Hujanen, 2005). Niektóre raporty wykazały, że ekstrakty ziołowe mają potencjał hamujący przerzutowość i angiogenezę komórek nowotworowych raka wątrobokomórkowego poprzez zmniejszenie ekspresji MMP2 i VEGF in vitro i in vivo (Huang et al., 2009; Zhang et al., 2009). Badania te sugerują, że TCM (tradycyjne, chińskie produkty lecznicze) mogą odegrać kluczową rolę w zapobieganiu przerzutom nowotworowym i zjawisku przeciwangiogenezy poprzez wyjaśnienie molekularnych ścieżek różnych nowotworów, które są przez nie modulowane.
Zależność wzrostu guza i przerzuty do naczyń krwionośnych sprawiają, że angiogeneza jest racjonalnym celem terapii nowotworowej (Carmeliet and Jain, 2000). Angiogeneza jest krytycznym krokiem związanym ze wzrostem guza i rozprzestrzenieniem się przerzutów. Nowe tworzenie się naczyń krwionośnych zależy od regulacji białek angiogenicznych. Wśród nich, jednym z najistotniejszych czynników proangiogennych jest naczyniowo-śródbłonkowy czynnik wzrostu (VEGF) i jego receptory, które biorą udział w angiogenezie (Hicklin and Ellis, 2005). VEGF odgrywa kluczową rolę w angiogenezie guza, a jego ekspresja jest w sposób odwrotnie proporcjonalny związana z przeżywalnością pacjentów w wielu nowotworach, włączając nowotwór złośliwy jelita grubego (LoganCollins et al., 2011; Zafirellis et al., 2011). VEGF jest nie tylko ważny przy angiogenezie nowotworów, ale także bierze udział w gojeniu ran i innych ważnych patologiach (Ferrara, 1995). VEGF i jego receptory są integrowane za pomocą integryn, aby pobudzać adhezję komórek do macierzy zewnątrzkomórkowej (ECM). Badania wykazały, że ekspresja zarówno VEGF jak i integryny odgrywa decydującą rolę w pobudzaniu degradacji ECM i pośredniczeniu w inwazji komórek nowotworowych poprzez MMP9 w nowotworach złośliwych jelita grubego i żołądka (Wang et al., 2008; Zhao et al., 2010). Ekspresja VEGF jest regulowana poprzez różne ścieżki sygnalizacji, wywołane przez zewnętrzne bodźce i kontekst komórkowy (Xu et al., 2005). Cascio et al. (2009) stwierdził, że ekspresja VEGF w linii komórek nowotworowych jelita grubego (HT-29) została wywołana poprzez ścieżkę sygnału nabłonkowego czynnika wzrostu (EGF) (Cascio et al., 2009). Raporty wykazały także, że ekstrakty ziołowe oraz wywary zmniejszały angiogenezę guza poprzez zahamowanie ekspresji VEGF w różnych nowotworach (Lee et al., 2011; Hsu et al., 2011).
Dlatego też badanie to miało za cel określenie skuteczności wywaru TXL i jego bioaktywnych składników poprzez modulację ekspresji MMP2, MMP7, MMP9 i VEGF w komórkach i ksenograftach nowotworu złośliwego jelita grubego na poziomie molekularnym i poziomie białek, ponieważ są one markerami przerzutów oraz wskazują na skuteczność terapii nowotworowej.
2. Materiały i metody
2.1. Substancje ziołowe i przygotowanie
Środek Tian-Xian w płynie (TXL) jest komercyjnie dostępnym chińskim wywarem leczniczym. Uprzejmie udostępnionym przez firmę China-Japan Feida Union Company Limited. Jest on wodnym ekstraktem z chińskiej mieszanki ziół zawierającej przeważnie 10 chińskich ziół leczniczych: Korzeń żeń-szenia 12,5%, Cordyceps 24%, korzeń Traganka błoniastego (Radix Astragali) 15%, korzeń Lukrecji (Radix Glycyrrhizae) 5% , Owoc kolcowoju (Jagody Goji) 11%, Proszek perłowy (Margarita) 4%, owoc Lycium (Fructus Lycii) 9% , Lakownica (Ganoderma) 17%, Ligustr lśniący (Fructus Ligustri Lucidi) 0,5% i ziele Tarczycy brodatej (Herba Scutellariae Barbatae) 2%. Próbki były przechowywane w Szkole Medycyny Chińskiej, Wydział Medyczny LKS, Uniwersytet w Hong Kongu.
Próbka TXL (100ml) została rozpuszczona w wodzie i podzielona kolejno octanem etylu i butanolem. Cząsteczki wodne (WA), octanu etylu (EA) i butanolu zostały zebrane oddzielnie do różnych butelek. Cząsteczki wodne, octan etylu i butanol zostały odparowane do 60, 8 i 30 g do dalszych eksperymentów. Kontrola jakości cząsteczek została przeprowadzona tak jak opisano w poprzedniej publikacji (Sze et al., 2011).
2.2. Przeszczepy ksenogeniczne u nagich myszy, podanie leku i usunięte próbki guza
Eksperyment został zatwierdzony przez Wydział Zdrowia, Hong Kong SAR and Committee on the Use of Live Animals in Teaching and Research (CULATR) wydziału Medycznego Li Ka Shing na Uniwersytecie w Hong Kongu. 7 do 8 tygodniowe samice nagich myszy (bezgrasiczych) zostały zakupione z Oddziału Zwierząt Laboratoryjnych uniwersytetu w Hong Kongu. Myszy były trzymane w warunkach sterylnych w odosobnionych, wolnych od patogenów komorach w temperaturze otoczenia 22–24 ◦ C i względnej wilgotności 50–65% z 12 godzinnymi cyklami oświetlenia. Zawiesina komórek została uzyskana poprzez trypsynizację zlanych komórek HT-29. Komórki nowotworowe HT-29 zostały umiejscowione podskórnie u nagich myszy (bezgrasiczych) poprzez wstrzyknięcie 1x 105 komórek do prawego uda każdego zwierzęcia. Gdy po przeszczepie ksenogecznicznym guzy stały się wyczuwalne, myszy zostały losowo podzielone na 2 grupy, każda po 6 zwierząt. TXL, BU i WA były podawane doustnie w ilości 200 µL codziennie przez 16 dni. Natomiast grupa referencyjna zamiast tych substancji otrzymywała doustnie taką samą ilość wody. Rozmiar guza był mierzony codziennie przy użyciu cyfrowej suwmiarki i wyliczony przy użyciu równania= (długość w mm x szerokość w mm x wysokość w mm). Ciężar ciała wszystkich zwierząt był mierzony przez cały eksperyment jako ocena toksyczności leku.
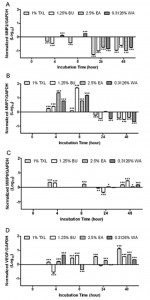
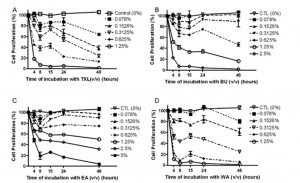 Fig. 1. Efekty antyproliferacyjne produktu TXL i jego bioaktywnych składników w komórkach HT-29, komórki HT-29 traktowane były przy użyciu stężeń TXL, BU, EA i WA. Test MTT został wykonany w odstępach 4, 8, 15, 24 i 48 h. Komórki HT-29 nietraktowane tymi substancjami stanowiły grupę referencyjną. Wartości IC50 produktu TXL i jego bioaktywnych składników na komórki HT-29 zostały uzyskane przy użyciu 1% (v/v) TXL, 1,25% (v/v) (A), BU 0,3125% (v/v) (B) i WA (D) po 4 h inkubacji i EA 5% (v/v) (C) po 8h inkubacji. Wyniki wykazały, że TXL i jego bioaktywne komponenty wywołały efekty antyproliferacyjne na komórki HT-29 w zależności od dawki i czasu. Dane zostały uzyskane z trzech niezależnych eksperymentów.
Fig. 1. Efekty antyproliferacyjne produktu TXL i jego bioaktywnych składników w komórkach HT-29, komórki HT-29 traktowane były przy użyciu stężeń TXL, BU, EA i WA. Test MTT został wykonany w odstępach 4, 8, 15, 24 i 48 h. Komórki HT-29 nietraktowane tymi substancjami stanowiły grupę referencyjną. Wartości IC50 produktu TXL i jego bioaktywnych składników na komórki HT-29 zostały uzyskane przy użyciu 1% (v/v) TXL, 1,25% (v/v) (A), BU 0,3125% (v/v) (B) i WA (D) po 4 h inkubacji i EA 5% (v/v) (C) po 8h inkubacji. Wyniki wykazały, że TXL i jego bioaktywne komponenty wywołały efekty antyproliferacyjne na komórki HT-29 w zależności od dawki i czasu. Dane zostały uzyskane z trzech niezależnych eksperymentów.
Na koniec eksperymentu wszystkie zwierzęta zostały poddane eutanazji poprzez dyslokację kręgów szyjnych. Ich próbki komórek nowotworowych zostały zebrane i przechowywane w −80 ◦ C do dalszej analizy transkrypcyjnej i translacyjnej przy pomocy metody real-time PCR lub techniki Western blot.
2.3. Linia komórkowa i hodowla komórek
Linia ludzkich komórek nowotworowych HT-29 (HTB-38, ATCC, Rockville, MD, USA) została wyhodowana w medium RPMI-1640 uzupełnionym 10% bydlęcą surowicą płodową i 1% antybiotyków (100 IU/mL penicyliny i 100 mg/mL siarczanu streptomycyny) (Hyclone, Logan, UT, USA). Komórki zostały inkubowane w temperaturze 37 ◦ C w inkubatorze utrzymującym 5% CO2 i pasażowane, gdy się zbiegły.
2.4. Efekt antyproliferacyjny TXL i jego komponentów na komórki HT-29
Komórki HT-29 były hodowane w 96 płytkach dołkowych o gęstości 1 × 104 komórek/0,1 mL/płytkę. Komórki były odseparowane od serum przez 24h a następnie inkubowane z szeregiem stężeń TXL, BU, EA i WA (5, 2.5, 1.25, 0.625, 0.3125, 0.1526 and 0.078%) na 4, 8, 15, 24, 33 i 48 h. Zahamowanie proliferacji komórek zostało ocenione przy pomocy testu MTT (4,5 – Dimetylotiazol – 2-yl – 2,5 – difenylo – tetrazoliny bromek) (Chu et al., 2011). Po lizie komórek z DMSO absorbancja została zmierzona używając spektrofotometru o długości fali 595 nm i 655 nm jako wartości referencyjnej. Otrzymane dane były w trzech kopiach.
2.5. Określenie ekspresji mRNA komórek HT-29 i przeszczepów senogenicznych leczonych TXL i jego komponentami bioaktywnymi – przy użyciu metody real-ktime PCR
Komórki HT-29 były leczone TXL (1%), BU (1,25%), EA (2,5%) i WA (0,6%) przez 4, 8, 24 i 48 h a ksenografty zostały pobrane od nagich myszy (bezgrasiczych) leczonych TXL i bioaktywnymi sunstancjami. Ekstrakcja całego RNA została wykonana dla każdej próbki przy użyciu zestawu High Pure Isolation kit (Roche Applied Science, USA). Próbki kontrolne (nieleczone produktem) także zostały ujęte. 2 µg całego RNA każdej próbki zostało odwrotnie przetranskrybowane do cDNA z primerami Oligo-dt przy użyciu zestawu do syntezy nici cDNA (Revert First strand cDNA synthesis kit) (Fermentas). Pary primerów i sondy do badania real-time PCR zostały zaprojektowane przez Assay Design Centre -Universal ProbeLibrary (Roche Applied Science, USA). Docelowe geny obejmowały MMP2 (NM 004530.4; 63 nt; forward: ataacctggatgccgtcgt; reverse: aggcacccttgaagaagtagc; Probe ID: #70, cat. no. 04688937001), MMP7 (NM 002423.3; 128 nt; forward: tggacggatggtagcagtct; reverse: tctccatttccataggttggat; Probe ID: #6, cat. no. 04685032001), MMP9 (NM 004994.2; 67 nt; forward: gaaccaatctcaccgacagg; reverse: gccacccgagtgtaaccata; Probe ID: #6, cat. no. 04685032001) i VEGF (NM 001025370.1; 74 nt; forward: ctacctccaccatgccaagt; reverse: ccacttcgtgatgattctgc; Probe ID: #29, cat. no.: 04687612001). Dehydrogenaza gliceroaldehydofosforanowa (GAPDH) została użyta jako odnośnik. Metoda real-time PCR została wykonana w systemie multipłytkowym- 384-multiwell plate of LightCycler® 480. Wyniki zostały przeanalizowane przy użyciu LightCycler® 480 Software, Version 1.5.
2.6. Analizy techniką Western blot komórek HT-29 i wyciętych próbek guza leczonych produktem TXL i bioaktywnymi komponentami
Komórki HT-29 , które były leczone TXL (1%), BU (1,25%), EA (2,5%) and WA (0,6%) w różnych odstępach czasowych: 0, 4, 8, 15, 24, 33, 48 h i wycięte próbki guza leczone tym produktem zostały poddane lizie, a stężenie białek zostało określone przy użyciu testu białkowego Bio-Rad (Bio-Rad Protein Assay) (Bio-Rad, Richmond, CA). 15 µg denaturowanego białka z komórek zarówno nieleczonych jak i leczonych produktem TXL zostało oddzielone na 10% żelu poliakrylamidowym z dodatkiem siarczanu dodecylu sodu, a rozpuszczone aminokwasy zostały przeniesione do błony PVDF (Roche Diagnostics Corporation, Indianapolis, IN, USA). Błona została zablokowana w 5% albuminie bydlęcej (Sigma) na 1h w temperaturze pokojowej, później zainkubowana przez noc w temperaturze 4 ◦ C z pierwszorzędowymi przeciwciałami rozpoznającymi, w szczególności MMP2, MMP7, VEGF (Santa Cruz Biotechnology) i MMP9 (Millipore). Następnie została ona przemyta TBS-T trzy razy i błony zostały inkubowane z peroksydazą chrzanową (HPR), połączoną z drugorzędnymi antyciałami (Santa Cruz Biotechnology i Dako Cytomation) w buforze TBS-T przez 1h. Detekcja chemiluminescencyjna (GE Bio-health) została uzyskana przy użyciu peroksydazy chrzanowej połączonej z drugorzędnymi antyciałami (SantaCruz Biotechnology). Detekcja została przeprowadzona przy użyciu systemu Advanced Chemiluminescence Western blotting detection system (GE Bio-health). Intensywności pasma zostały określone ilościowo poprzez densytometr BioRad Chemi DocTM EQ i oprogramowanie Bio-Rad Quantity One (Bio-Rad Laboratories, Hercules, USA). Każda intensywność pasma została znormalizowana do swojego pasma intensywności anty -GADPH (MAB374, Millipore).
2.7. Badanie stopnia migracji komórek – wound healing assay.
Procedury wpływu migracji komórek zostały zmodyfikowane (Chu et al., 2011). Pokrótce, komórki HT-29 (3x 104) zostały rozsiane w 24 płytkach dołkowych i pozostawione na noc w 37 ◦ C z 5% CO2. Po zgomadzeniu się komórek wykonano rysę końcówką pipety 200-µL. Odseparowane komórki i szczątki zostały usuniętę i przemyte w roztworze soli fizjologicznej buforowanej fosforanami (PBS). Komórki zostały potem potraktowane produktem TXL oraz BU, EA i WA; użyto komórek referencyjnych. Zamknięcie rany poprzez migrujące komórki, jeśli w ogóle, zostało zaobserwowane przy użyciu mikroskopu z kontrastem fazowym (Carl Zeiss) połączonego z kamerą CDD w przeciągu 24 i 48h po zastosowaniu produktu. Uszkodzony obszar każdej próbki został określony za pomocą NIH Image Software. Wpływ produktu, zależny od dawki, na uszkodzone komórki HT-29 w określonym czasie został wyrażony jako tempo migracji w porównaniu z nieleczonymi komórkami referencyjnymi. Dane zostały zanalizowane za pomocą testu two-way ANOVA.
Tempo migracji (%)
2.8. Analiza statystyczna
Program GraphPad Prism wersja 5.02 został użyty do analizy otrzymanych wyników. Wszystkie dane są przedstawione jako średnia i odchylenie standardowe (S.D.). Wartość AP mniejsza niż 0,05 (P < 0,05) została uznana za statystycznie znaczącą.
3. Wyniki
3.1.Efekty antyproliferacyjne produktu TXL i jego bioaktywnych składników
Efekty antyproliferacyjne produktu TXL i jego bioaktywnych składników, BU, EA i WA na komórki HT-29 określone były przy użyciu testu MTT. Rysunek 1 (Fig.1) przedstawia efekty antyproliferacyjne produktu TXL (Fig. 1A), BU (Fig. 1B), EA (Fig. 1C) i WA (Fig. 1D) na komórki HT-29 w różnych stężeniach (5%, 2,5%, 1,25%, 0,625%, 0,3125%, 0,1526% i 0,078%) i różnych odstępach czasowych (0, 4, 8, 15, 24 and 48 h). Komórki traktowane 0% stężeniem zostały wprowadzone jako wartość referencyjna. Wyniki wskazały, że TXL i jego bioaktywne komponenty wywołały efekt antyproliferacyjny na komórki HT-29 uzależniony od dawki i czasu. Wartości IC50 w komórkach HT-29 były 1% (v/v) TXL, 1,25% (v/v) BU i 0,3125% (v/v) WA po 4 h inkubacji i 2,5% (v/v) EA po 8 h inkubacji. Te wartości zostały użyte w kolejnym eksperymencie.
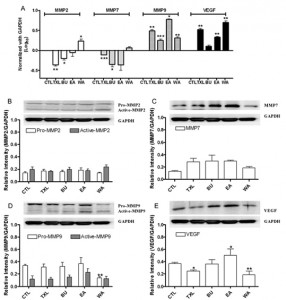
Fig. 2. Modulacje in vitro ekspresji mRNA MMP2, MMP7, MMP9 i VEGF przy zastosowaniu TXL i jego komponentów bioaktywnych. Wszystkie 4 produkty wykazały statystycznie znaczące zmniejszenie ekspresji zarówno mRNA MMP2 (A) jak i MMP7 (B) po 24h i 48h inkubacji. (C) Zaobserwowano jedynie nieznaczne zmniejszenie ekspresji mRNA MMP9 przy zastosowaniu BU. (D) Wszystkie 4 produkty zwiększyły ekspresję mRNA VEGF po 48h inkubacji. Dane zostały uzyskane z trzech niezależnych eksperymentów przy użyciu metody real-time PCR (***P < 0,001; **P < 0,01; *P < 0,05; oraz two-way ANOVA).
3.2. Modulacje in vitro ekspresji mRNA MMP2, MMP7, MMP9 i VEGF w komórkach HT-29 przy użyciu TXL i jego komponentów bioaktywnych
Modulacja ekspresji mRNA białek nowotworowych w komórkach HT-29 wywołana przez TXL i jego komponenty bioaktywne została określona metodą real-time PCR (LC480, Roche) na poziomie transkrypcji.
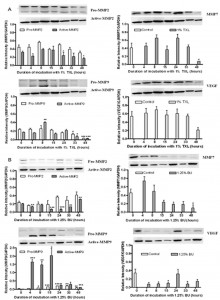
Fig. 3. Modulacja in vitro ekspresji białka MMP2, MMP7, MMP9 i VEGF przez TXL i jego komponenty aktywne, TXL znacząco zahamował ekspresję białek MMP2, MMP7 i VEGF w 48h inkubacji. (A) TXL również znacząco zmniejszył ekspresję białka MMP9 po 33 i 48h inkubacji (*P < 0,05; ***P < 0,001; przy zastosowaniu Student’s ttest). (B) po 15, 24 i 33h inkubacji, BU znacznie zmniejszył ekspresję białek MMP2. Poczynając od 15h inkubacji BU znacznie obniżył ekspresję białka MMP9. Także obniżył ekspresję białka VEGF poczynając od 4h inkubacji (*P < 0,05; **P < 0,01; ***P < 0001; przy zastosowaniu Student’s t-test). (C) EA znacząco obniżyło jedynie zarówno pro jak i aktywną formę białka MMP2. Ekspresja białka dla MMP7, MMP9 i VEGF EA znacznie zwiększył ekspresję wszystkich tych białek (*P < 0,05; **P < 0,01; ***P < 0001; przy zastosowaniu Student’s t-test). (D) WA znacząco obniżyło jedynie ekspresję białka MMP2 po 8h inkubacji a później stopniowo zwiększyło ekspresję do jej początkowego poziomu. WA znacząco wzmożyło i podwyższyło ekspresję białka MMP9 i spowodowało nieznaczny wzrost ekspresji białka VEGF (*P < 0,05; **P < 0,01; przy zastosowaniu Student’s t-test). Wszystkie dane zostały uzyskane z 3 do 8 odrębnych eksperymentów.
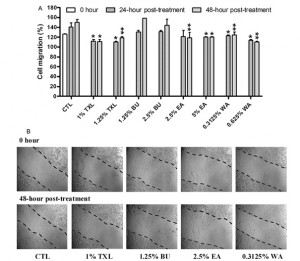
Fig. 4. Obniżenie zdolności do przerzutów komórek HT-29 dzięki TXL i jego bioaktywnych komponentów. Zdolności komórek HT-29 do przerzutów po leczeniu produktem TXL i jego bioaktywnymi komponentami została określona przy pomocy testu funkcjonalnego: testu wound-healing. (A) (1% i 1,25%), EA (5%) i WA (0,3125% i 0,625%) znacznie zahamowały efekt gojenia się rany w komórkach HT-29 w porównaniu z komórkami kontrolnymi po inkubacji przez 24 h i 48h (*P < 0,05 i **P < 0,01; przy wykorzystaniu Student’s t-test). Co więcej, BU (1,25% i 2,5%) nie miał żadnego wpływu na zdolność do przerzutów komórek HT-29 w porównaniu z komórkami kontrolnymi w obydwu przedziałach czasowych. (B) Reprezentatywne obrazy komórek kontrolnych (CTL), TXL i ich substancje po inkubacji 0h i 48 h są pokazane dla porównania. Dane zostały uzyskane z trzech niezależnych eksperymentów.
Na rysunku 2A (Fig. 2A) TXL i jego komponenty bioaktywne znacznie obniżyły poziom ekspresji mRNA MMP2 w komórkach HT-29 po 24 i 48-h inkubacji (***P < 0,001; przy zastosowaniu metody two-way ANOVA). Na rysunku 2B (Fig. 2B) TXL i jego komponenty bioaktywne obniżyły ekspresję mRNA MMP7 w komórkach HT-29 w zależności od czasu inkubacji (***P < 0,001; przy zastosowaniu metody two-way ANOVA). Z drugiej jednak strony, BU i WA początkowo podwyższyły ekspresję MMP7 po 4 i 8 h od zastosowania produktu. Jednakże, gdy czas stosowania produktu został wydłużony do 24 i 48 h ekspresja mRNA MMP7 przy zastosowaniu BU i WA również zmalała (***P < 0,001; przy zastosowaniu metody two-way ANOVA). Na rysunku 2C (Fig. 2C) TXL i jego komponenty bioaktywne obniżyły ekspresję mRNA MMP9 w komórkach HT-29 (***P < 0,001; przy zastosowaniu metody two-way ANOVA). Jednakże, TXL i inne dwie substancje wywołały niewielki wzrost ekspresji mRNA MMP9. Na rysunku 2D (Fig 2D) TXL i jego komponenty wywołały wzrost ekspresji mRNA VEGF po 48 h leczenia.
3.3. Modulacje in vitro ekspresji białek MMP2, MMP7, MMP9 i VEGF w komórkach HT-29 przy zastosowaniu TXL i jego substancji bioaktywnych
Modulacja ekspresji białek MMP2 (pro i aktywne formy), MMP7, MMP9 (pro i aktywne formy) i VEGF przy użyciu 1% (v/v) TXL, 1,25% (v/v) BU, 2,5% (v/v) EA i 0,3125% (v/v) WA w komórkach HT-29 zostały ocenione używając analizy Western blotting w różnym czasie (0, 4, 8, 15, 24, 33 i 48 h). TXL znacznie obniżył ekspresję białek MMP2, MMP7, MMP9 i VEGF w komórkach HT-29 po 48-h inkubacji (*P < 0,05 i***P < 0,001; przy zastosowaniu Student’s t-test) (Fig. 3A). Ekspresja zarówno pro jak i aktywnych form MMP2 i MMP9 została zahamowana, gdy wzrósł czas inkubacji. Zahamowanie ekspresji białek MMP7, MMP9 i VEGF zostało stwierdzone w komórkach HT-29 leczonych BU (*P < 0,05; **P < 0,01; ***P < 0,001; przy zastosowaniu Student’s t-test) (Fig. 3B). EA znacznie obniżył ekspresję pro i aktywnych form MMP2, w komórkach HT-29 po 0.05-h inkubacji (*P < 0,05;**P < 0,01;***P < 0,001; przy zastosowaniu Student’s t-test). W porównianiu EA zwiększyło po leczeniu ekspresje białek MMP7, MMP9 i VEGF (Fig. 3C). Z drugiej jednak strony, WA znacząco obniżyło jedynie ekspresję białka MMP2 po 8h inkubacji, a później stopniowo zwiększyło jego ekspresję do początkowego poziomu. WA znacząco wzmożyło i podwyższyło ekspresję białka MMP7 i MMP9 oraz spowodowało nieznaczny wzrost ekspresji białka VEGF (*P < 0,05; **P < 0,01; przy zastosowaniu Student’s t-test). To oznacza, że WA ma tylko krótkotrwały efekt hamujący na funkcję MMP2 w komórkach HT-29. Z powyższych danych wynika, że 1% (v/v) TXL w połączeniu ze swoimi substancjami bioaktywnymi wykazuje znaczne obniżenie funkcji tych czterech białek w komórkach HT-29 w testach in vitro. Stąd też można wnioskować, że TXL ma duży potencjał przeciwprzerzutowy i antyangiogeniczny w komórkach HT-29.
3.4. Obniżenie zdolności do przerzutów komórek HT-29 dzięki TXL i jego bioaktywnym składnikom.
Efekt przeciwprzerzutowy TXL, BU, EA i WA na komórki HT-29 został określony przy użyciu testu wound-healing (gojenia ran). TXL (1% i 1,25%), EA (5%) i WA (0,3125% i 0,3125% i 0,625%) znacznie zahamowały efekt gojenia się rany w komórkach HT-29 w porównaniu z komórkami kontrolnymi po inkubacji przez 24 h i 48h (*P < 0,05 i **P < 0,01; przy wykorzystaniu Student’s t-test). (Fig. 4A). Jednakże, BU (1,25% i 2,5%) nie miał żadnego wpływu na zdolność do przerzutów komórek HT-29 w porównaniu z komórkami kontrolnymi w obydwu przedziałach czasowych. Reprezentatywne obrazy komórek kontrolnych (CTL), TXL i ich substancje po inkubacji 0h i 48 h są pokazane dla porównania na rysunku 4B (Fig. 4B). Wyniki wskazują, że TXL, EA i WA obniżyły zdolność do przerzutów komórek HT-29.
3.5. Modulacja in vivo rozmiaru guza i masy przeszczepów ksenogenicznych nowotworu jelita grubego przy zastosowaniu TXL i jego substancji bioaktywnych
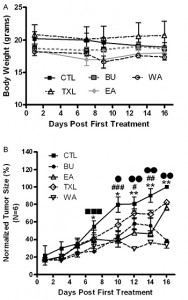
Ksenografty nowotworu jelita grubego były leczone TXL, BU, EA i WA kolejno przez 16 dni. Nie zaobserwowano żadnej znaczącej zmiany w masie wszystkich leczonych ksenograftów nowotworu w porównaniu z grupą kontrolną, wykazując, że żaden z produktów nie wykazywał toksyczności in vivo. (Fig. 5A). TXL i wszystkie jego substancje wykazały znaczne zmniejszenie rozmiaru guza po 16 dniach leczenia w porównaniu z grupą kontrolną (CTL vs TXL: *P < 0,05; **P < 0,01; CTL vs WA: P < 0,05; P < 0,01; CTL vs BU: P < 0.001; przy zastosowaniu testu t dla prób zależnych). EA wykazał stopniowy wzrost rozmiaru guza po 14 dniach leczenia, był on wciąż jednak mniejszy niż w grupie kontrolnej (CTL vs EA: # P < 0,05; ## P < 0,01; ### P < 0,001; przy zastosowaniu testu t dla prób zależnych), wykazując tym samym, że efekt przeciwnowotworowy był tylko tymczasowy (Fig. 5B).
3.6. Modulacje w testach in vivo ekspresji MMP2, MMP7, MMP9 i VEGF na poziomach transkrypcji i translacji przy zastosowaniu TXL i jego komponentów bioaktywnych.
Modulacje ekspresji MMP2, MMP7, MMP9 i VEGF na poziomach transkrypcji i translacji przy zastosowaniu TXL i jego komponentów bioaktywnych. zostały określone przy użyciu metody real-time PCR (LC480, Roche) i analizy Western blot. Na poziomie transkrypcji w porównaniu do wartości kontrolnej TXL, BU i EA ograniczyły ekspresję mRNA MMP2 i MMP7 , ale zmniejszyły ekspresję MMP9 i VEGF (*P < 0,05; **P < 0,01; ***P < 0,001; przy zastosowaniu Student’s t-test). WA jednakże zwiększyło wszystkie ekspresje mRNA w przeszczepach ksenogenicznych (Fig. 6A). Z drugiej jednak strony, na poziomie translacji jedynie TXL znacznie obniżył ekspresję białka VEGF (*P < 0,05; przy zastosowaniu Student’s t-test) (Fig. 6D), a WA obniżyły ekspresję białek MMP9 i VEGF ( **P < 0,01; przy zastosowaniu Student’s t-test) (Fig. 6D i E). Nie było jednak znaczącej zmiany ekspresji białek MMP2 i MPP7 w przeszczepach ksenogenicznych przy zastosowaniu TXL, BU i EA (Fig. 6B and C).
Fig. 5. Modulacja in vivo rozmiaru guza i masy przeszczepów ksenogenicznych nowotworu przy zastosowaniu TXL i jego substancji bioaktywnych. Myszom nagim (bezgrasiczym) wstrzyknięto podskórnie komórki ludzkiego nowotworu złosliwego jelita grubego. Gdy po przeszczepie ksenogecznicznym guzy stały się wyczuwalne, TXL, BU, EA i WA podawane były myszom doustnie. Myszy kontrolne natomiast, zamiast substancji leczniczych otrzymywały wodę. (A) Przeszczepy ksenogeniczne raka jelita grubego były leczone produktami kolejno przez 16 dni. Nie zaobserwowano żadnej znaczącej zmiany w masie wszystkich leczonych ksenograftów nowotworu w porównaniu z grupą kontrolną, wskazując, że żaden z produktów nie wykazywał toksyczności in vivo. (B) Dla rozmiaru guza, TXL oraz jego składniki spowodowały znaczne zahamowanie wielkości guza po 16 dniach leczenia w porównaniu z grupą kontrolną. EA wykazał stopniowy wzrost w rozmiarze guza po 14 dniach leczenia jednak był on wciąż niższy niż w grupie kontrolnej. To wskazuje, że efekt przeciwnowotworowy EA był chwilową reakcją (CTL vs TXL: *P < 0,05; **P < 0,01; CTL P < 0,01; CTL vs vs EA: # P < 0,05; ## P < 0,01; ### P < 0,001; CTL vs WA: P < 0,05; P < 0,001; przy zastosowaniu testu t dla prób zależnych). Dane uzyskane z 6 odrębnej grupy eksperymentów BU sześć myszy (N = 6).
4. Dyskusja
Niezwykle ważne jest, aby zrozumieć mechanizmy molekularne płynu Tian-Xian (TXL) jako alternatywa dla przeciwnowotworowych wywarów leczniczych. Nasze poprzednie badanie wykazało, że TXL był skuteczny w hamowaniu komórek nowotworowych ludzkiego raka jelita grubego (HT-29) poprzez regulację cyklu komórki oraz związanych z nim białek (Sze et al., 2011). Aby nadal objaśniać mechanizmy przeciwnowotworowe produktu TXL została wprowadzona nowa linia komórek HT-29 jako model in vitro do badań jego potencjału antyprzerzutowego i angiogenicznego.
Fig. 6. Modulacje w testach in vivo ekspresji MMP2, MMP7, MMP9 i VEGF na poziomach transkrypcji i translacji przy zastosowaniu TXL i jego komponentów bioaktywnych. Markery białek przerzutowych ksenograftów leczonych TXL i jego komponentami bioaktywnymi zostały określone przy użyciu metody real-time PCR oraz analizy Western blot, zarówno na poziomie transkrypcji jak i translacji. (A) Na poziomie transkrypcji, w porównaniu do wartości referencyjnej TXL, BU i EA miały podobny i znaczący wpływ na obniżenie ekspresji mRNA zarówno MMP2 jak i MMP7, ale wzrost ekspresji MMP9 i VEGF (*P < 0,05; **P < 0,01; ***P < 0,001; przy zastosowaniu Student’s t-test). Jednakże WA zwiększyły wszystkie ekspresje mRNA w przeszczepach ksenogenicznych. Z drugiej jednak strony, na poziomie translacji nie odnotowano żadnej znacznej zmiany w ekspresji białek MMP2 (B) i MMP7 (C) przy zastosowaniu TXL, BU, EA i WA w przeszczepach ksenogenicznych. TXL obniżył jednak ekspresję białka VEGF (*P < 0,05; przy zastosowaniu Student’s t-test) (D) a WA obniżyły zarówno ekspresję białka MMP9 (D) jak i VEGF (E) (**P < 0,01; przy wykorzystaniu Student’s t-test). Dane zostały uzyskane z 6 odrębnych eksperymentów (N = 6).
Jest to pionierskie badanie potwierdzające potencjał przeciwprzerzutowy i angiogeniczny produktu TXL na komórki HT-29. Po pierwsze, nasze wyniki wskazały, że TXL, BU, EA i WA efektywnie hamowały proliferację komórek HT-29 w zależności od podanej dawki i czasu (Fig. 1). Efekt hamujący produktu TXL na komórki HT-29 cells był zgodny z naszymi wcześniejszymi publikacjami (Liu et al., 2011; Sze et al., 2011). Jest to dowód na to, że chiński preparat leczniczy TXL i jego komponenty bioaktywne mogłyby uśmiercić ludzkie komórki nowotworowe. Niedawny raport zbadał wpływ TXL na wzrost efektu hamującego kilka linii ludzkich komórek nowotworowych, takich jak rak wątrobowokomórkowy, szyjki macicy i płuc wskazując, że TXL skutecznie zabija te komórki, w sposób wprost proporcjonalny do czasu, nie zabijając przy tym ludzkich jednojądrzastych komórek krwi obwodowej (Sun et al., 2005a). To zasugerowało, że cytotoksyczny wpływ TXL w in vitro na normalne komórki ludzkie jest umiarkowany.
Zahamowanie MMP w leczeniu nowotworu odbywa się na trzech poziomach: transkrypcji, aktywacji pro-MMP oraz zahamowania MMP (Leber and Efferth, 2009). Kilka rodzajów MMP wyzwala migrację komórek, jednakże ostatnie odkrycia sugerują, że pośredniczą one w chemotaksji nawet bez użycia proteolitycznej domeny. MMP2 i MMP9 są głównymi białkami przerzutowymi wydzielanymi przez komórki nowotworowe podczas tworzenia się przerzutowych guzów nowotworowych (Leber and Efferth, 2009). Udokumentowano, że VEGF odgrywa kluczową rolę w angiogenezie guza w różnych rodzajach nowotworów u ludzi (Birk et al., 2011). VEGF jest silnym czynnikiem angiogenicznym, który jest regulowany przez szereg innych czynników takich jak hipoksja, czynniki wzrostu i hormony. Regulacja VEGF może wymagać obecności innych białek w tkankach i być zależna od sposobu leczenia, np. sygnalizacja wapniem, stabilność mRNA i potranskrypcyjna regulacja; w ten sposób mogła wyniknąć wzajemna ekspresja mRNA i ekspresja poziomu białek (Misquitta et al., 2011). MMP2, MMP9 i VEGF są cechami charakterystycznymi przerzutowych komórek nowotworowych lub angiogenezy. Dufour et al. (2008) twierdził, że protoonkogeny (prekursory) MMP2 i 9 wzmagają migrację komórki w teście „komorowym” (ang. transwell chamber assay). Nasze badanie in vitro potwierdziło, że TXL i EA zmniejszyły ekspresję MMP2 zarówno na poziomie transkrypcji jak i translacji po 24 i 48 h inkubacji (Figs. 2A i 3A oraz C), równocześnie znacznie zmniejszając przy tym przerzutowość komórek HT-29 (Fig. 4A). MMP2 jest białkiem rozpuszczalnym, które wymaga potranslacyjnej modyfikacji zewnątrzkomórkowej, aby osiągnąć biologiczną aktywność (Roberts et al., 2011). Nasze wyniki sugerują, że zarówno TXL jak i EA mogą odgrywać rolę w kontrolowaniu potranslacyjnej modyfikacji MMP2 w in vitro. Także TXL i pozostałe 3 składniki zahamowały ekspresję MMP7 zarówno na poziomie transkrypcji jak i translacji (Figs. 2B i 3A–D), ukazując, że TXL i EA mają wielokierunkowe działanie hamowania przerzutów komórek HT-29.
Stwierdzono także, że zahamowanie ekspresji VEGF doprowadziło do zmniejszenia ekspresji MMP9 w komórkach nowotworowych żołądka, zmniejszając w ten sposób migrację komórek i vice versa (Zhao et al., 2011). Mimo, że zaobserwowano jedynie niewielką zmianę ekspresji mRNA MMP9 po zastosowaniu TXL i jego komponentów (Fig. 2C), to jednak ilościowy wzrost ekspresji białka MMP9 w komórkach HT29 (Fig. 3A–D) został określony po leczeniu tym produktem. W porównaniu z innymi lekami BU spowodował większą ekspresję białek aktywnej MMP9 w komórkach HT-29; dlatego też wykazał niższy efekt migracji antykomórek (Figs. 3B i 4A). Została stwierdzona także znaczna redukcja ekspresji białka VEGF w komórkach leczonych TXL (Fig. 3A), przez co udowodniono, że TXL działał na wielorakie białka nowotworowe i w badaniach in vitro wykazywał działanie przeciwprzerzutowe. Pomimo słabej korelacji pomiędzy poziomami transkrypcji i translacji w MMP2, MMP7, MMP9 i VEGF po zastosowaniu TXL i jego komponentów bioaktywnych, udowodniono i potwierdzono, że TXL i jego komponenty bioaktywne w znacznym stopniu zahamowały migrację komórek HT-29 do zranionego obszaru przy zastosowaniu testu wound-healing (Fig. 4A i B).
Niedawne badanie wykazało, że ziołowy ekstrakt hamował wzrost guza ksenograftu ludzkiego nowotworu wątrobokomórkowego poprzez zmniejszenie ekspresji VEGF i MMP2 (Huang et al., 2008). W badaniu in vivo, wyniki dowiodły, że TXL i jego substancje nie były toksyczne dla zwierząt, co zostało określone na podstawie masy ciała (Fig. 5A). Poza tym, zaobserwowano znaczną redukcję rozmiaru guza ksenograftów leczonych lekiem w porównaniu do grupy kontrolnej (Fig. 5B). Zmniejszenie ekspresji mRNA MMP2 i MMP7 zostało uzyskane dzięki leczeniu przy użyciu TXL, BU i EA przeszczepów ksenogenicznych (Fig. 6A), które odpowiadały wynikom naszego badania in vitro (Figs. 2A, B i 3A–C). Nie było jednak oczywistego obniżenia ekspresji białek MMP2 i MPP7 przez TXL, BU i EA (Fig. 6B and C). Podobnie TXL spowodował wzrost ekspresji mRNA VEGF w testach in vivo, ale nie na poziomie białkowym (Fig. 6E). Dla MMP9 TXL i jego substancje wpłynęły na wyższą ekspresję mRNA w ksenograftach, jednakże zmniejszenie białka MMP9 (Fig. 6D) wskazuje, że TXL i jego substancje mogą uczestniczyć w modulacji kontroli potranslacyjnej MMPs. Zmienny poziom mRNA i białek MMP i VEGF mogły być spowodowane potranskrypcyjną regulacją, stabilnością mRNA, wydajnością translacyjną lub obecnością mikroRNA (Yan and Boyd, 2007; Fanjul-Fernandez et al., 2011). Niedawna analiza wykazała, że mikroRNA także mogą uczestniczyć w regulacji MMP. MikroRNA są w stanie negatywnie regulować ekspreję genu na poziomie potranskrypcyjnym poprzez represję translacji lub poprzez degradację ich mRNA na sekwencje docelowe (Fanjul-Fernandez et al., 2010). Pomimo, że badanie to nie może potwierdzić, co powoduje te rozbieżności w poziomie ekspresji, możemy jednak stwierdzić, że ksenografty były znacznie osłabione sądząc po rozmiarze guza (Fig. 5B). Dlatego też wpływ mechanizmu TXL i jego komponentów na potranslacyjną kontrolę białek MMP jest nadal nieznany i wymaga dalszych badań. Jednakże wyniki uzyskane powyżej sugerują, że chiński preparat ziołowy TXL wykazał wyższą skuteczność zmniejszania potencjału przerzutowego komórek ludzkiego raka jelita grubego w in vitro i in vivo, w porównaniu z jego bioaktywnymi komponentami. Sugeruje to także, że dalsze badania mechanizmów działania chińskich preparatów ziołowych w leczeniu ludzkich nowotworów złośliwych są warte kontunuowania.
5. Wnioski
Podsumowując, niniejsze badanie dowiodło, że TXL wywarł wieloraki wpływ na komórki ludzkiego nowotwóru złosliwego jelita grubego poprzez zmniejszenie markerów przerzutowych i angiogenicznych, zarówno na poziomie transkrypcji jak i translacji. Jednakże jego komponenty bioaktywne nie przyniosły takich efektów w obydwu modelach badania. Niniejsze badanie przyniosło ważne spostrzeżenia na temat wielorakich cech chińskich preparatów leczniczych, włączając produkt TXL, oraz dostarczyło wiele istotnych dowodów naukowych na to, że chińskie preparaty lecznicze jako komplementarna dieta będą miały zastosowanie w leczeniu ludzkich nowotworów w przyszłych badaniach klinicznych.
Podziękowania
Autorzy chcieliby podziękować Dr Hu YM za frakcjonowanie TXL. Badanie zostało sfinansowane w części przez dotację z Programu Seed Funding for Applied Research (no.: 200807160015) i umowę o finansowanie badań przez firmę China-Japan Feida Union Company Limited.
Źródła